经济影响与成本效益 尽管初期投入较高(平均每企业需50万欧元),但eCTD可减少30%的审评延迟成本,长期效益。仿制药企业通过eCTD复用原研数据,节省80%的申报准备时间。欧盟预算拨款2亿欧元资助中小企业完成数字化转型。 伦理审查与数据隐私 eCTD中的患者数据需匿名化处理,符合《通用数据保护条例》(GDPR)要求。临床试验模块(模块5)的提交需附带伦理委员会批准文件,且区域版本需体现各国伦理审查差异。AI辅助匿名化工具在保护隐私的同时提升数据处理效率。 技术融合与跨领域应用 eCTD格式扩展至医疗器械和保健品领域,欧盟试点eCTD-MDR项目整合ISO标准。基因产品的eCTD需附加生物安全数据库,并与欧盟基因库实时同步。未来,eCTD或与电子健康档案(EHR)系统对接,支持个性化用药。 持续改进与行业反馈机制 EMA每年发布eCTD实施报告,分析常见错误并更指南。行业联盟(如EFPIA)通过定期研讨会向监管机构反馈技术痛点,推动标准优化。开放式API接口的推广将促进eCTD工具链的互操作性,降低技术锁定风险。加拿大eCTD验证标准相关技术支持。无锡仿制药eCTD找哪家
电子签章与安全性 FDA要求所有PDF文件需经数字签名,并通过MD5校验确保传输完整性。签章需符合21 CFR Part 11的电子记录规范,部分情况下允许临时放宽(如期间的远程签署)。 多模块协同验证 模块1(行政文件)的区域性元数据(如申请类型、联系人信息)需与模块2-5的内容逻辑一致。例如,生物制品的3.2.R扩展节点命名需遵循特定规则,而化学药品则禁止使用此类扩展。 验证工具与流程 主流工具如LORENZ eValidator支持自动化验证,生成包含错误定位与修复建议的详细报告。企业需在提交前完成内部验证,并通过“药品业务应用系统”推送受理状态。 常见问题与规避策略 高频错误包括PDF安全设置、书签链接失效、STF(研究标签文件)缺失等。例如,未在5.3.1章节标注研究ID会导致验证警告,需通过说明函解释。企业可通过建立标准化模板库和预检流程降低风险。 后续监管与更 FDA定期更验证标准(如2022年增临床试验数据完整性检查),企业需通过订阅官方通知或第三方服务商获取动态南京eCTD推荐澳大利亚eCTD申报软件相关技术支持。
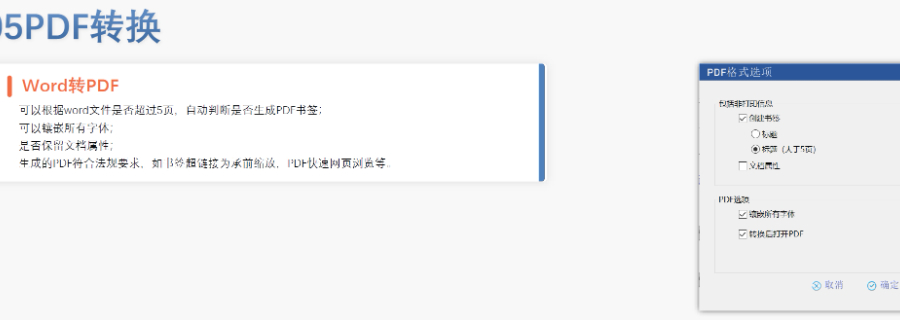
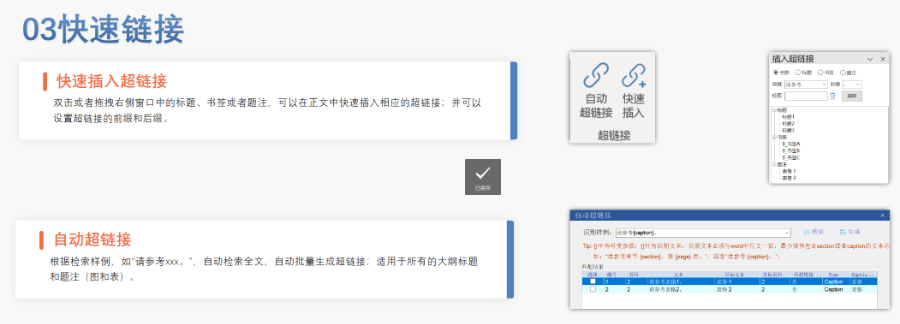
赋悦Word插件 自主研发Word插件 快速编辑:整合word常用功能按钮,避免频繁切换菜单;内置标题、段落、文字、目录、超链接等的格式和样式,可快速设置和更文档的格式 快速链接:双击或者拖拽的方式,制作文本超链接或者题注超链接;可搜索全文关键字,自动制作超链接 文档拆分:可根据不同的条件将word文件颗粒化,如分节符、页眉、页脚、页码范围和自定义页码等 PDF转换:WORD转PDF,自动判断是否生成书签,自动镶嵌所有字体,生成PDF快速网页浏览的PDF,确保生成的PDF所有属性符合法规要求 文档验证:验证文档的字体、字号、纸张、页面布局、空白页、页码、编号、目录、超链接等,并且可以定位验证结果 可定制:可根据用户需求定制格式和样式模板
美国eCTD的强制实施时间与范围:美国自2017年5月5日起要求药申请(NDA)、仿制药申请(ANDA)和生物制品许可申请(BLA)必须通过eCTD格式提交,2018年5月5日进一步扩展至临床试验申请(IND)和药品主文件(DMF)。FDA通过《联邦食品、药品和化妆品法案》第745A条明确电子提交的强制性,豁免非商业化IND和部分DMF类型(如Ⅲ类)。2023年数据显示,FDA接收的eCTD申请占比已达92%,标志着电子化审评体系的成熟。企业若未按规范提交(如缺少文件或重复序列号),将直接被拒收。瑞士eCTD注册申报相关技术支持。

欧盟eCTD的递交途径与技术要求 不同审评程序对应不同递交渠道:集中程序(CP)通过EMA的eSubmission Gateway或Web Client提交,分散程序(DCP)和互认程序(MRP)则需使用欧盟通用提交门户(CESP)。文件结构需严格遵循模块化要求,例如CEP申请需包含模块1(行政文件)、模块2(质量概述)和模块3(技术文档),且XML主干文件须符合EDQM的特定命名规则。此外,所有PDF文件需无密码保护、可全文检索,并嵌入层级书签以支持快速审阅。 CEP申请的eCTD递交特殊性 CEP程序自2018年起强制采用eCTD格式,重点评估原料药是否符合欧洲药典标准。其模块1需包含EDQM申请表、简历及变更说明表,模块2需使用EDQM提供的质量概述模板,模块3则按CTD格式组织3.2.S章节内容。CEP与ASMF(活性物质主文件)的主要区别在于性:CEP无需关联上市许可,且审评由EDQM完成。澳大利亚ANDA注册申报相关技术支持。芜湖仿制药eCTD性价比
欧盟eCTD注册外包相关技术支持。无锡仿制药eCTD找哪家
《中国eCTD验证实践手册》作为2025年2月发布的技术指南(发布日期见),为药品注册申请人提供了系统化的eCTD申报验证操作指引。该手册基于《中国eCTD验证标准V1.0》的框架,重点覆盖验证流程中的六大关键领域:基础识别、文件/文件夹规范、ICH骨架文件完整性、区域性管理信息校验、研究标签文件(STF)逻辑性及PDF技术合规性。手册特别强调对"错误警告提示"三级验证结果的差异化处理策略,指导申请人通过赋悦eCTD软件进行元数据填报、STF节点配置及扩展节点合规性检查,同时针对中国特有的注册类型差异提出模块化申报资料准备方案。对于PDF文档,手册细化到书签路径、超链接属性及字体嵌入等技术细节,确保电子资料符合CDE审评系统的解析要求。此外,手册还结合生物制品与化学药品的申报差异,明确了3.2.R扩展节点的使用限制,并通过案例解析说明函与申请表生命周期的管理规则。无锡仿制药eCTD找哪家
赋悦科技(杭州)有限责任公司汇集了大量的优秀人才,集企业奇思,创经济奇迹,一群有梦想有朝气的团队不断在前进的道路上开创新天地,绘画新蓝图,在浙江省等地区的数码、电脑中始终保持良好的信誉,信奉着“争取每一个客户不容易,失去每一个用户很简单”的理念,市场是企业的方向,质量是企业的生命,在公司有效方针的领导下,全体上下,团结一致,共同进退,**协力把各方面工作做得更好,努力开创工作的新局面,公司的新高度,未来赋悦科技供应和您一起奔向更美好的未来,即使现在有一点小小的成绩,也不足以骄傲,过去的种种都已成为昨日我们只有总结经验,才能继续上路,让我们一起点燃新的希望,放飞新的梦想!