欧盟eCTD的历史沿革与强制实施 欧盟自2003年逐步推进eCTD(电子通用技术文档)的标准化进程,初要求药注册申请(MAA)采用CTD格式。2010年,集中审评程序(CP)率先强制使用eCTD,随后分散程序(DCP)和互认程序(MRP)分别于2015年、2017年跟进。至2019年,欧盟要求所有国家程序(NP)的注册申请均以eCTD格式提交,标志着其电子递交体系的成熟。2024年,EMA启动eCTD4.0试点项目,旨在提升技术兼容性与审评效率。 eCTD验证标准的迭代与关键更 欧盟的验证标准历经多次调整,例如2025年3月启用的eCTD3.1区域模板和验证规则v8.1,对文件结构、元数据和内容完整性提出更严格的要求。标准引入的“追踪表(Tracking Table)”强制校验规则(如15.11和15.12)曾导致CEP(欧洲药典适用性证书)递交,后通过允许占位文件临时解决。与早期版本相比,v8.1强化了对模块一区域信息的逻辑验证,并细化了对PDF书签、超链接的规范性检查。澳大利亚eCTD注册外包相关技术支持。宁波生物制品eCTD服务价格
仿制药作为提高药物可及性与可负担性的一类药物,2012年以前,注册审评是不收取任何费用的,但当时仿制药申请积压严重,从申报到获批需要3~5年的时间。 美国国会于2012年颁布了仿制药使用者费用修正案(Generic Drug User Fee Amendments, GDUFA),该法律要求制药行业支付一定的用户费用,以补充仿制药申请的审评以及现场检查的费用,减少仿制药申请积压,缩短审评时间,增加基于风险的现场检查等,其目的是加快公众获得安全有效的仿制药,并降低行业成本。 GDUFA必须每五年重授权一次,于2017年更(GDUFA II),于2022年更(GDUFA III); 目前收费种类分为以下四种:ANDA审评费、DMF审评费,在审评时一次性缴纳;项目费(Program fee)、设施费(Facility fee),是上市后每年缴纳一次。山东化学药品eCTD服务商美国eCTD注册咨询相关技术支持。
电子签章与安全性 FDA要求所有PDF文件需经数字签名,并通过MD5校验确保传输完整性。签章需符合21 CFR Part 11的电子记录规范,部分情况下允许临时放宽(如期间的远程签署)。 多模块协同验证 模块1(行政文件)的区域性元数据(如申请类型、联系人信息)需与模块2-5的内容逻辑一致。例如,生物制品的3.2.R扩展节点命名需遵循特定规则,而化学药品则禁止使用此类扩展。 验证工具与流程 主流工具如LORENZ eValidator支持自动化验证,生成包含错误定位与修复建议的详细报告。企业需在提交前完成内部验证,并通过“药品业务应用系统”推送受理状态。 常见问题与规避策略 高频错误包括PDF安全设置、书签链接失效、STF(研究标签文件)缺失等。例如,未在5.3.1章节标注研究ID会导致验证警告,需通过说明函解释。企业可通过建立标准化模板库和预检流程降低风险。 后续监管与更 FDA定期更验证标准(如2022年增临床试验数据完整性检查),企业需通过订阅官方通知或第三方服务商获取动态
技术壁垒与兴市场挑战 非洲和东南亚国家逐步采纳eCTD,但其IT基础设施薄弱导致实施进度滞后。欧盟通过“eCTD全球化倡议”提供技术援助,帮助兴市场建立验证体系和培训中心。跨国药企需针对不同区域定制递交策略,例如在模块1附加本地稳定性数据。 监管科学与创激励 eCTD支持真实世界证据(RWE)和适应性临床试验设计的整合,加速创药上市。EMA的PRIME计划为突破性疗法提供eCTD快速通道,允许分阶段提交模块数据。孤儿药和儿科药的eCTD序列可享受费用减免和优先审评。 供应链安全与审计追踪 eCTD的XML主干文件记录所有提交版本,支持供应链问题的追溯分析。原料药CEP持有者需及时更变更信息,确保下游制剂厂商获取数据。区块链技术试点用于追踪eCTD数据流,防止篡改和未授权访问。 文化差异与实施障碍 部分南欧国家偏好传统纸质流程,导致eCTD推广阻力较大。EMA通过多语种培训材料和区域协调员制度促进文化适应。行业需调整管理思维,将eCTD从“合规负担”转化为“竞争优势”。欧盟IND注册申报相关技术支持。
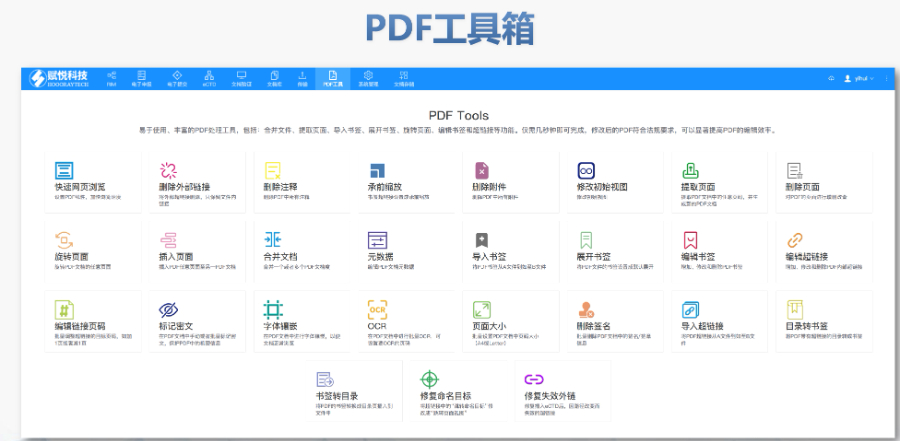
PDF工具箱 批量处理与格式修复 支持PDF合并、拆分、提取页面、旋转页面等操作,可批量修复字体未嵌入、超链接错误等问题,确保文件符合药品注册法规要求。 智能书签与超链接管理 提供书签导入/导出、超链接自动生成(支持关键字搜索定位链接)、题注超链接拖拽式编辑等功能,简化复杂文档的导航设计。 文档转换与OCR识别 支持Word转PDF(自动生成书签、嵌入字体),以及PDF与Word、Excel等格式互转,集成OCR功能用于扫描件文字识别。 合规性验证 自动验证PDF的页面布局、页码连续性、空白页、目录层级等属性,并定位具体错误位置,减少人工检查成本。 安全与协作功能 支持文档加密、数字签名、云端同步及多设备共享,满足企业级文件安全管理需求。瑞士eCTD注册申报相关技术支持。江苏中国eCTD发布软件
美国eCTD注册外包相关技术支持。宁波生物制品eCTD服务价格
美国药物主文件(Drug Master File, DMF)是向FDA提交的机密技术文件,用于支持药品生产、质量控制及合规性审查。以下为申报的要点和流程总结: DMF概述与类型 定义与作用 DMF是药品生产全过程的详细档案,包含原料药、辅料、包装材料等的生产设施、工艺、质量控制等信息,供制剂厂商引用以支持其注册申请。其意义在于保护企业机密的同时,满足FDA对供应链透明度的要求。 DMF类型 Ⅱ类:原料药、中间体及制剂(如微生物外泌体、细胞株等生物制品均属此类)。 Ⅲ类:包装材料。 Ⅳ类:辅料、着色剂等添加剂。 Ⅴ类:非临床/临床数据等特殊信息(需FDA预先批准)。 注:Ⅰ型(生产设施与人员)已于2000年停用。宁波生物制品eCTD服务价格