仿制yao作为提高yao物可及性与可负担性的一类yao物,2012年以前,注册审评是不收取任何费用的,但当时仿制yao申请积压严重,从申报到获批需要3~5年的时间。美国国会于2012年颁布了仿制yao使用者费用修正案(GenericDrugUserFeeAmendments,GDUFA),该法律要求制yao行业支付一定的用户费用,以补充仿制yao申请的审评以及现场检查的费用,减少仿制药申请积压,缩短审评时间,增加基于风险的现场检查等,其目的是加快公众获得安全you效的仿制yao,并降低行业成本。GDUFA必须每五年重授权一次,于2017年更(GDUFAII),于2022年更(GDUFAIII);目前收费种类分为以下四种:ANDA审评费、DMF审评费,在审评时一次性缴纳;项目费(Programfee)、设施费(Facilityfee),是上市后每年缴纳一次。 美国NDA注册申报相关技术支持。eCTD服务放心可靠
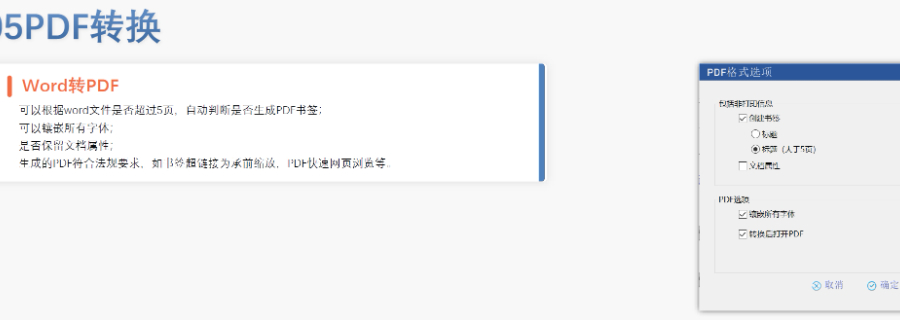
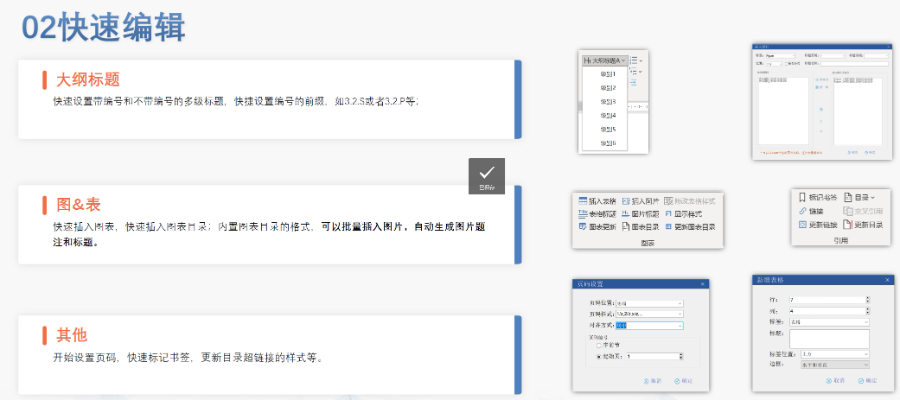
eCTD文件制作需遵循严格的法规要求和标准化流程,以下是关键要点整理:eCTD采用模块化结构,包含模块1(行政信息)至模块5(临床报告),需按ICH和监机构要求构建目录树。颗粒度选择:文件提交层级需在***申报时确定并沿用,例如原料和制剂的章节(如、)需按比较低颗粒度拆分,辅料单独成章。PDF需添加书签(导航目录)和超链接(跨网页跳转),超过5页的文件必须包含目录(TOC/LOT/LOF)。技术参数:初始视图需设置默认缩放级别和页面布局,书签展开层级不超过三级,单文件大小需符合申报系统限制。验证工具:使用软件(如BXeCTD)自动生成书签和超链接,并通过序列校验和PDF校验功能确保合规性。无锡电子申报eCTD服务价格瑞士ANDA注册申报相关技术支持。
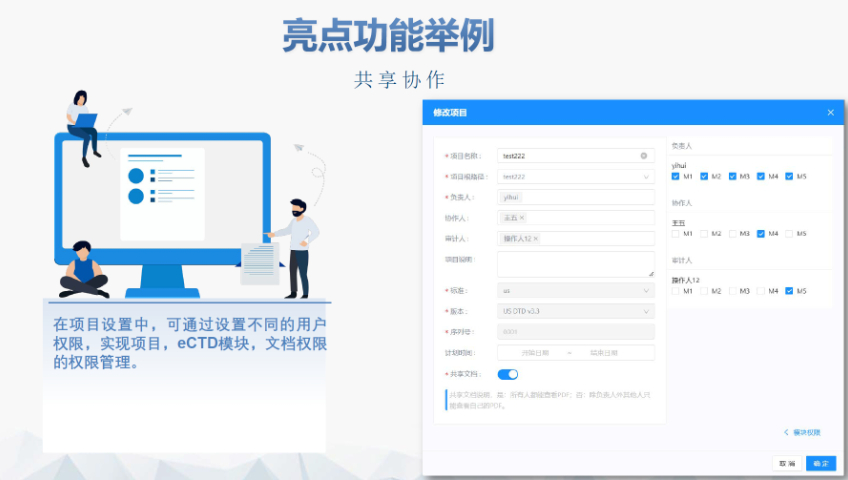
此次eCTD实施范围的扩大对外企而言影响。实施范围的扩大为外企提供了更多选择,特别是在产品线中NDA和AND占比相当的情况下。外企的系统和流程相对成熟,因此它们对eCTD扩大范围持积极态度,更愿意尝试和改变。尽管过程中可能遇到技术或法规上的问题,但企业认为通过不断反馈和与CDE沟通,能够帮助提高整体申报效率和质量。此外,外企还面临向更集成化法规信息管理系统的挑战,特别是当需要迁移到系统时。如果尽早将产品迁移到eCTD,无论是系统迁移还是后续的生命周期管理都会更加顺畅。 随着eCTD实施范围的扩大,供应商将拥有更多的业务机会。然而,中国药品注册体系相对年轻化,在推进eCTD实施过程中可能面临各种问题。短期内,中小企业可能面临资金压力,需要考虑是否投入资金购买的eCTD系统。中长期来看,企业更关注的是如何建立一套完善的文档管理体系,而不是完成递交。这需要企业在前期投入更多时间和精力进行流程优化和人员培训。
eCTD的技术架构与模块要求:美国eCTD基于XML技术,严格遵循ICHM4框架,分为5个模块:模块1(地区行政信息)、模块2(技术总结)、模块3-5(质量、非临床与临床数据)。其中,模块1需包含FDA特定的,涵盖申请编号、联系人和DMF授权书等行政信息。模块2-5需与ICHCTD全球统一标准一致,但FDA对文件颗粒度要求更细,例如非临床研究报告需拆分并标记StudyID。PDF文件需符合FDA,包括字体嵌入、书签层级和超链接功能。eCTD的技术架构与模块要求:美国eCTD基于XML技术,严格遵循ICHM4框架,分为5个模块:模块1(地区行政信息)、模块2(技术总结)、模块3-5(质量、非临床与临床数据)。其中,模块1需包含FDA特定的,涵盖申请编号、联系人和DMF授权书等行政信息。模块2-5需与ICHCTD全球统一标准一致,但FDA对文件颗粒度要求更细,例如非临床研究报告需拆分并标记StudyID。PDF文件需符合FDA,包括字体嵌入、书签层级和超链接功能。 欧盟CESP提交通道相关技术支持。
eCTD的实施为监管机构和企业带来了多重机遇。电子化申报资料能够极大地加速审评效率,减少人为判断错误和数据混淆的情况,从而提高审评的准确性和速度。同时,eCTD带来的数据标准化机遇使得全球监管机构的资料内容和电子格式得以统一,有助于在不同监管机构之间进行数据传输和共享。这对于提升全球监管效率和行业研发效率具有重要意义。此外,eCTD的实施还促进了全球合作,构建了全球监管的底层大数据基础。对于企业而言,eCTD提供了一个规范化的研发活动模板,有助于降低与监管机构沟通的成本,提高申报效率。特别是对于国内的医技术企业而言,eCTD的实施更是具有重要意义,有助于这些企业更好地走向全球市场。然而,中小企业在享受这些机遇的同时,也面临着技术和成本压力。eCTD的实施需要专门的团队进行系统维护和开发,这对于中小企业来说是一笔不小的开支。同时,数据安全问题也是企业关注的焦点。此次CDE扩大eCTD实施范围对行业而言是一个积极的风向标。短期内,企业面临的挑战包括适应更高要求的技术规范并提高文件质量、和eCTD出版系统的磨合以及进行eCTD知识的跨职能培训等。中DMF注册申报相关技术支持。浦东新区仿制药eCTD
澳大利亚eCTD申报软件相关技术支持。eCTD服务放心可靠
争议解决与法律救济若申请人对审评结果有异议,可向EMA的CHMP申请重审查,或在欧盟法院提起行政诉讼。eCTD的完整提交记录可作为法律证据,证明申请人已履行合规义务。EDQM设立仲裁wei员会,处理CEP程序中的技术争议。行业趋势与竞争格局全球eCTD服务市场年增长率达12%,欧盟占据35%份额,主要服务商包括PharmaLex、Certara等。头部yao企通过自建IT团队降低成本,而中小型企业依赖外包以专注研发。人工智能(AI)在文件自动生成和审评意见预测中的应用逐渐增多。患者参与与透明度提升EMA通过公开eCTD摘要(如模块)增强审评透明度,患者可提交意见影响审评决策。部分成员国要求模块1包含患者语言版本说明书,以提升用yao依从性。未来,,实现全生命周期互动。 eCTD服务放心可靠