生物制品的临床前安全性评价是药物研发的关键环节,其主要目标在于通过系统化的实验设计,预测药物在人体中的潜在风险,为临床试验提供科学依据。以疫苗为例,其安全性评价需贯穿原辅材料控制、生产工艺验证、理化性质检定、动物试验及临床前监测全流程。动物试验作为主要手段,需模拟人体免疫应答,重点考察疫苗对免疫organ(如胸腺、脾脏)及靶organ(如肝脏、肾脏)的影响,评估毒性可逆性及超敏反应风险。例如,流感疫苗的临床前研究需通过豚鼠主动过敏试验,预测其引发Ⅰ型超敏反应的可能性;而PD-1抑制剂等tumor免疫医疗药物,则需通过非人灵长类动物模型,验证其阻断免疫检查点后的自身免疫风险。评价体系构建需遵循“具体问题具体分析”原则,结合药物作用机制、种属特异性及临床适应症设计试验。对于细胞因子类药物,需考虑其多向性、网络性效应可能引发的“瀑布效应”,如重组人促红的细胞生成素可能同时纠正贫血与促进tumor生长的双重风险。此外,杂质控制是安全性评价的重要环节,宿主细胞蛋白质、DNA残留及内jisu等工艺相关杂质,可能通过免疫复合物沉积导致损伤,需通过纯化工艺优化及质控标准制定降低风险。临床前实验降低研发风险,环特生物定制化设计实验方案。云南中药临床前安全性评价单位

化妆品行业的规范化发展,使得临床前安全性评价成为产品研发的必备环节,直接关系到产品的市场准入与消费者健康。杭州环特生物科技股份有限公司针对化妆品研发特点,搭建了多维度的临床前安全性评价平台。该平台结合斑马鱼模型、细胞毒性实验、皮肤刺激性测试等方法,多方面评估化妆品原料与成品的安全性。在临床前研究中,通过斑马鱼胚胎毒性实验可快速检测产品的潜在致畸风险;皮肤刺激性测试则模拟人体皮肤接触场景,判断产品是否存在刺激隐患。此外,针对美白、淡斑等特殊功效化妆品,临床前研究还需验证功效成分的安全性,避免因成分超标或不合理搭配引发健康问题。环特生物的临床前安全性评价服务,帮助化妆品企业规避研发风险,确保产品符合国家备案标准。宁波成都中药临床前 药物临床前药物筛选是发现候选药物的重要环节。

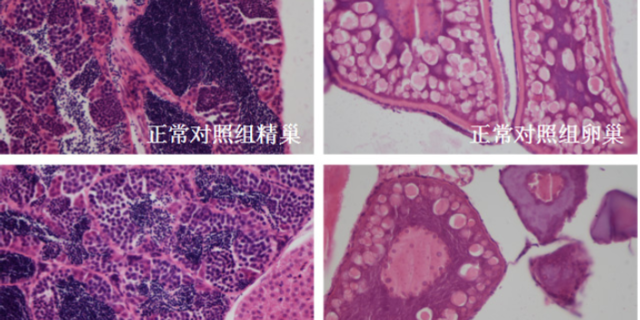
遗传毒性研究通过Ames试验(细菌回复突变)、小鼠淋巴瘤试验(TK基因突变)及染色体畸变试验(如中国仓鼠卵巢细胞试验),评估药物是否可能引发基因突变或染色体损伤,从而增加ancer或遗传病风险。例如,某化疗药物在Ames试验中呈阳性,提示其可能具有致ancer性,需在临床试验中设置长期随访监测。生殖毒性研究则覆盖胚胎-胎仔发育毒性(EFD)、围产期毒性及两代的生殖毒性,评估药物对生育力、胚胎发育及后代的影响。以抗癫痫药物为例,在EFD实验中,大鼠在50mg/kg/天剂量下出现胎仔脊柱裂,提示育龄女性用药需严格避孕。此类研究需遵循ICH(国际人用药品注册技术协调会)S5指南,确保数据满足全球监管要求(如FDA、EMA)。
生物大分子的免疫原性是其临床前安全性评价的重点。即使人源化抗体仍可能引发抗药物抗体(ADA)产生,导致疗效降低或过敏反应。临床前需通过ELISA、流式细胞术及T细胞依赖性影响试验(TDAR)评估免疫原性风险。例如,在TNF-α抑制剂开发中,TDAR试验可检测药物对T细胞增殖及细胞因子分泌的影响,预测潜在免疫相关不良反应。脱靶毒性则需通过高通量筛选技术(如KinomeScan)评估药物对非靶标激酶的交叉结合能力,避免因脱靶效应导致的organ毒性。例如,某EGFR抑制剂因意外结合HER2受体,在临床前猴模型中引发严重心脏毒性,终导致项目终止。此外,重复给药毒性试验需持续观察动物体重、血液生化指标及组织病理学变化,为临床剂量设计提供依据。环特生物依托类organ技术,优化临床前实验研究维度.
体外药效评估是临床前研究的起点,通过高灵敏度技术(如荧光标记、流式细胞术)量化候选药物对靶点的直接作用。针对激酶抑制剂,常用酶联免疫吸附试验(ELISA)或表面等离子共振(SPR)测定其对靶酶的抑制活性(如IC50、Ki值);针对抗体药物,则通过流式细胞术检测其与抗原的结合亲和力(KD值)。细胞水平实验进一步验证药物对疾病相关细胞的功能影响,例如:抗tumor药物需在多种ancer细胞系(如A549肺ancer细胞、MCF-7乳腺ancer细胞)中测试增殖抑制率(通过MTT法或Brdu掺入法);抑炎药物需在巨噬细胞中检测炎症因子(如TNF-α、IL-6)的分泌抑制效果。此外,3D细胞模型(如tumor球体、类organ)可模拟体内微环境,更真实地反映药物穿透性及细胞间相互作用。例如,某EGFR抑制剂在2D细胞实验中IC50为10nM,但在3Dtumor球体中需50nM才达同等效果,提示需优化结构以提升穿透性。临床前研究数据是药物进入临床试验的关键依据。北京化合物临床前研究服务平台
临床前实验涵盖药代动力学研究,环特生物提供多方面分析。云南中药临床前安全性评价单位
药物药效临床前研究是药物开发中验证医疗潜力的关键环节,其关键目标是通过系统实验证明候选药物在疾病模型中的有效性,为后续临床试验提供科学依据。研究需覆盖从分子水平到整体动物水平的多个维度,包括体外活性筛选(如酶抑制、细胞增殖/凋亡实验)、类organ/3D细胞模型验证、以及体内药效评估(如疾病动物模型)。例如,针对tumor药物,需在体外证明其对ancer细胞的杀伤作用(如IC50值),在类organ中验证其穿透tumor组织的能力,终在PDX(患者来源异种移植)模型中确认其抑制tumor生长的效果。研究设计需严格遵循“3R原则”(替代、减少、优化),以小化动物使用量并提升数据可靠性。据统计,临床前药效研究充分的候选药物进入临床试验后的成功率可提升30%-50%,凸显其作为药物开发“道关卡”的重要性。云南中药临床前安全性评价单位