 首页 > 新闻中心
首页 > 新闻中心
 首页 > 新闻中心
首页 > 新闻中心

化学沉淀法通过改变蛋白质溶解环境实现分离。盐析法利用高浓度中性盐(如硫酸铵)破坏蛋白质表面水化膜及电荷平衡,使其沉淀,具有操作简单、成本低廉的优点,但需精确控制盐浓度以避免蛋白质变性;有机溶剂沉淀法(如bingtong、乙醇)通过降低介电常数减少蛋白质溶解度,适用于疏水性较强的蛋白质,但低温操作(0...

金属离子亲和色谱可用于蛋白的金属离子亲和固定化,用于亲和色谱柱的性能优化。尺寸排阻色谱可用于分析蛋白与配体的结合动力学,通过峰的变化曲线判断。离子交换色谱可用于调节蛋白的电荷性质以适应不同的分离目的。亲和色谱中,洗脱条件的精细优化可实现对蛋白的高纯度、高回收率纯化。疏水作用色谱中,不同的缓冲液添加剂...

疏水作用色谱中,蛋白的氨基酸序列和修饰影响其疏水特性,可通过基因工程优化分离。电泳技术中的变性聚丙烯酰胺凝胶电泳结合蛋白质测序技术可用于蛋白的一级结构分析。等电聚焦电泳可用于研究蛋白在不同细胞周期阶段的等电点变化。双向电泳可用于比较不同组织和正常组织的蛋白表达差异。超滤在蛋白浓缩时可采用连续切向流超...

疏水作用色谱中,蛋白的氨基酸序列和修饰影响其疏水特性,可通过基因工程优化分离。电泳技术中的变性聚丙烯酰胺凝胶电泳结合蛋白质测序技术可用于蛋白的一级结构分析。等电聚焦电泳可用于研究蛋白在不同细胞周期阶段的等电点变化。双向电泳可用于比较不同组织和正常组织的蛋白表达差异。超滤在蛋白浓缩时可采用连续切向流超...

电泳技术依据蛋白质电荷特性及分子量差异进行分离。常规电泳中,蛋白质在电场作用下向相反电荷电极迁移,迁移速率取决于分子大小及电荷量;SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)通过十二烷基硫酸钠(SDS)使蛋白质变性并带负电荷,实现分子量测定;等电聚焦电泳则在pH梯度凝胶中,使蛋白质迁移至等电点位置...

透析则是基于小分子能透过半透膜,而蛋白等大分子不能透过的原理。它可以去除蛋白溶液中的小分子杂质,如盐离子、缓冲剂等,进一步纯化蛋白样品。离子交换色谱是依据蛋白表面电荷差异进行分离的方法。带有不同电荷的蛋白会与离子交换树脂上的相反电荷基团结合,通过改变洗脱液的离子强度和pH值,可依次将不同蛋白洗脱下来...
亲和标签是蛋白纯化的有效策略。常见的His标签,由多个组氨酸组成,与镍离子具有高亲和力。将带有His标签的重组蛋白表达出来后,可通过镍离子亲和层析柱进行纯化。目标蛋白特异性地结合到柱子上,再用含有咪唑等竞争剂的洗脱液将其洗脱下来。还有谷胱甘肽-S-转移酶(GST)标签,能与谷胱甘肽琼脂糖珠特异性结合...

物理分离法利用蛋白质分子大小、密度等物理特性差异实现分离。透析通过半透膜截留大分子蛋白质,允许小分子杂质(如盐、代谢物)透出,常用于缓冲液置换;超滤法依赖压力驱动,使蛋白质溶液通过特定截留分子量的膜,实现浓缩与初步纯化,适用于大规模制备;离心技术则通过高速旋转产生的离心力,按密度差异分离细胞碎片、沉...

蛋白分离纯化是通过物理、化学及生物学手段,从复杂混合物中提取并纯化目标蛋白质的技术。其hexin在于去除杂质,获得高纯度、高活性的蛋白质,以满足研究、工业生产或医疗需求。该技术是生物化学、分子生物学及生物制药领域的基础,直接影响蛋白质结构解析、功能研究及药物开发效率。例如,在疫苗研发中,纯化后的抗原...

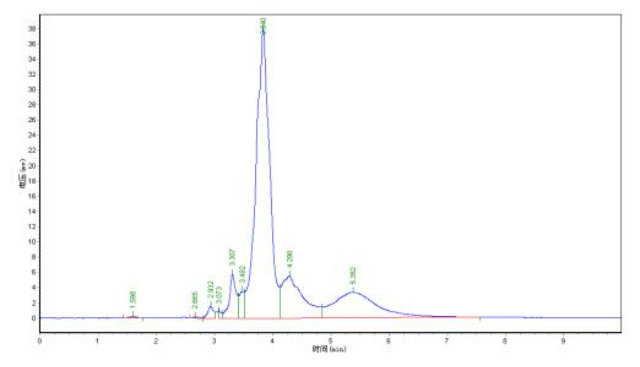
准确检测蛋白纯度是蛋白分离纯化的重要环节。高效液相色谱(HPLC)是常用方法之一,通过分析蛋白在色谱柱中的保留时间和峰形,可判断其纯度。峰形尖锐单一通常表示蛋白纯度较高。SDS-PAGE也是直观的纯度检测手段,纯度高的蛋白在凝胶上呈现单一清晰条带。如果出现多条条带,则说明存在杂质。紫外分光光度法利用...

亲和层析通过目标蛋白与固定相上配体的特异性结合实现“锁-钥”式分离。例如,His标签蛋白可与镍离子螯合柱结合,通过咪唑竞争洗脱获得高纯度产物;GST标签蛋白则利用谷胱甘肽与GST酶的亲和性,在含谷胱甘肽的缓冲液中洗脱。该方法特异性极强,可一步纯化至电泳纯级别,但需注意标签可能影响蛋白功能。优化策略包...
尺寸排阻色谱可用于评估蛋白的折叠状态,通过与标准蛋白比较。离子交换色谱可用于去除蛋白样品中的带相反电荷的杂质。亲和色谱中,配体与蛋白的结合常数对分离效果有重要影响,需优化。疏水作用色谱中,蛋白的浓度和盐浓度对疏水相互作用有协同影响,要综合考虑。电泳技术中的变性聚丙烯酰胺凝胶电泳可用于分析蛋白的亚基组...