耐药性已成为全球公共卫生危机,药物组合筛选为延缓耐药进化提供了新思路。传统研发周期长达10年,而通过筛选已知药物的协同组合,可快速开发出“复方”。例如,针对耐甲氧西林金黄色葡萄球菌(MRSA),β-内酰胺类(如头孢洛林)与β-内酰胺酶抑制剂(如他唑巴坦)的组合可恢复前者对细菌细胞壁的破坏作用;更前沿的研究发现,将与抑菌肽或金属纳米粒子联用,可通过物理膜破坏与化学靶点抑制的双重机制,明显降低耐药菌的存活率。此外,抗病毒药物组合筛选在中发挥重要作用:瑞德西韦与巴瑞替尼(JAK抑制剂)的联用通过抑制病毒复制和过度炎症反应,将重症患者死亡率降低30%。这些案例表明,药物组合筛选不仅能提升疗效,还可通过多靶点干预压缩耐药菌/病毒的进化空间。高通量药物筛选的意义有哪些?药物高通量筛选实验室

传统的药物组合筛选方法主要包括基于细胞实验的筛选和动物模型筛选。基于细胞实验的筛选是在体外培养的细胞系中,将不同药物以不同浓度组合添加,通过检测细胞的生长、增殖、凋亡等指标,评估药物组合的效果。这种方法操作相对简单、成本较低,能够在较短时间内对大量药物组合进行初步筛选。例如,通过 MTT 法、CCK-8 法等检测细胞活性,判断药物组合对细胞的抑制或促进作用。动物模型筛选则是将药物组合应用于实验动物,如小鼠、大鼠等,观察药物组合在体内的医疗效果和安全性。动物模型更接近人体生理环境,能够反映药物在体内的代谢、分布等情况,为药物组合的有效性和安全性提供更可靠的依据。但动物模型筛选成本高、周期长,且存在种属差异,实验结果不能完全准确地预测在人体中的效果。传统方法虽然在药物组合筛选中发挥了重要作用,但在面对海量药物组合时,其效率和准确性有待提高。酶抑制剂筛选高通量筛选的意义以及价值有哪些?

协同效应评估是药物组合筛选的关键环节,常用方法包括Loewe加和性模型、Bliss单独性模型及Chou-Talalay联合指数(CI)法。其中,CI值是宽泛接受的量化指标:CI<1表示协同作用,CI=1表示相加作用,CI>1表示拮抗作用。例如,在抗耐药菌组合筛选中,若A与B的CI值为0.5,表明两者联用可降低50%的用药剂量仍达到相同疗效,明显减少毒副作用。机制解析则需结合多组学技术(如转录组、蛋白质组及代谢组)与功能实验。例如,通过RNA测序发现,某抗tumor组合可同时下调PI3K/AKT与RAS/MAPK两条促ancer通路,解释其协同抑制tumor增殖的机制;通过CRISPR-Cas9基因编辑技术敲除特定靶点,可验证关键协同分子(如细胞周期蛋白D1)的作用。此外,单细胞测序技术可揭示组合用药对tumor异质性的影响,为精细医疗提供依据。
传统的原料药材筛选方法凝聚着历代医药学家的智慧,至今仍是药材质量把控的重要手段。首先是“看、闻、问、切”的感官鉴别法,通过观察药材的形状、色泽、质地,嗅闻气味,询问产地和采收时间,触摸药材的软硬、干湿程度,判断药材真伪与优劣。例如,质优的黄连根茎呈鸡爪状,表面黄褐色,断面鲜黄色且气微,味极苦;而伪品在外观和气味上均存在差异。其次是经验鉴别法,老药工凭借多年实践经验,对药材的加工、储存条件与质量关系了如指掌,如陈皮需陈化三年以上才能达到健脾的效果。再者,传统的净选和分级方法,通过挑选、风选、水选等方式去除杂质、非药用部位,并依据药材大小、重量、色泽等进行分级,确保入药品质均一。这些传统方法虽依赖经验,但在快速识别药材特征、传承中医药文化方面具有不可替代的作用。这个高通量筛选天然产品库不要错失——陶术化合物库!
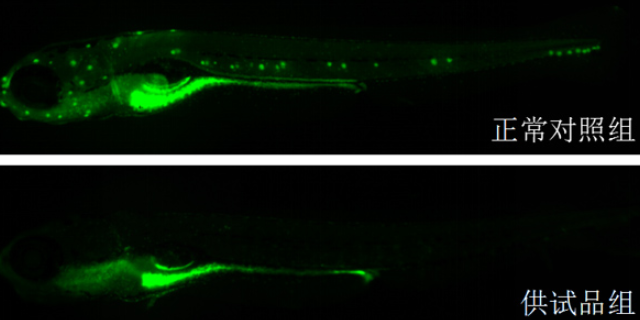
环特生物在环肽药物领域构建了多维度筛选平台,涵盖噬菌体展示、mRNA展示及结构导向设计等技术。噬菌体展示技术通过将环肽库展示在病毒表面,结合亲和筛选与扩增循环,可高效识别高亲和力结合物。例如,环特与RatmirDerda实验室合作,利用基于半胱氨酸的环化化学技术,生成了包含光电开关和糖肽的超大环肽库,成功筛选出针对碳酸酐酶(CA)的特异性抑制剂。在结构导向设计方面,环特借鉴Grossmann实验室的研究成果,通过模拟E-cadherin的β-片结构,设计出可抑制Tcf4/β-catenin相互作用的环肽,其IC50值达16μM,为Wnt信号通路相关ancer医疗提供了新候选分子。化合物在高通量筛选中的效果怎么样?蛋白高通量筛选实验
高通量筛选技能加速联合用药研讨。药物高通量筛选实验室
药剂筛选通常包括靶点验证、化合物库构建、筛选模型设计、数据解析与候选化合物优化五个阶段。靶点验证:通过基因敲除、RNA干扰等技术确认靶点与疾病的因果关系,例如验证某激酶在tumor信号通路中的关键作用。化合物库构建:包含天然产物、合成化合物、已上市药物再利用库等,需确保分子多样性和可获取性。例如,某些海洋天然产物因其独特结构成为新型抗菌剂的潜在来源。筛选模型设计:根据靶点类型选择合适的检测方法,如酶活性抑制、细胞信号通路影响或表型变化观察。数据解析:通过统计学方法(如Z-score、IC50计算)筛选活性化合物,并排除假阳性结果。例如,设置多重浓度梯度验证剂量效应关系。候选化合物优化:对初筛阳性化合物进行结构修饰(如引入亲脂基团改善膜通透性)、药代动力学研究(如半衰期、代谢稳定性)及安全性评估(如肝毒性测试),终确定临床前候选药物。例如,某抗糖尿病药物通过结构优化将口服生物利用度从10%提升至60%。药物高通量筛选实验室