近年来,技术融合推动了小分子药物临床前研究的革新。人工智能(AI)在靶点预测、化合物筛选中发挥关键作用,例如DeepMind的AlphaFold2预测蛋白质结构,加速了靶点发现;生成对抗网络(GAN)设计新型分子骨架,将先导化合物优化周期缩短60%。类organ与器官芯片(Organ-on-a-Chip)技术模拟人体微环境,提高药效学与毒理学评价的临床相关性。例如,肺类organ可重现入侵过程,用于筛选抗病毒药物;肝脏芯片则动态监测药物代谢产物对肝细胞的损伤。此外,3D生物打印技术构建复杂组织模型,如tumor血管化模型,可评估药物对tumor微环境的调控。这些创新技术使临床前研究从“经验驱动”转向“数据驱动”,明显提升了研发效率与成功率。环特生物依托类organ技术,优化临床前实验研究维度.宁波药品临床前毒理上市cro公司
环特生物的安全性评价体系聚焦于早期毒性预测与机制解析,通过斑马鱼胚胎毒性测试(ZET)、类organ毒性模型及计算毒理学方法,实现“安全窗口”前移。斑马鱼胚胎因其透明性,可直观观察化合物对心脏发育、神经管形成等organ发生过程的影响,例如在抗癫痫药物开发中,ZET检测发现某候选分子在10μM浓度下即可导致斑马鱼胚胎心脏循环障碍,提示潜在心脏毒性风险。类organ毒性模型则通过模拟人体组织对化合物的代谢启动过程,揭示肝毒性或肾毒性的分子机制,如某激酶抑制剂在肝类organ中诱导线粒体损伤,导致谷丙转氨酶(ALT)水平升高,该结果与临床前猴模型数据高度一致。计算毒理学通过定量构效关系(QSAR)模型和机器学习算法,预测化合物对特定靶organ的亲和力,例如基于ADMET(吸收、分布、代谢、排泄、毒性)预测平台,提前排除具有hERG通道抑制风险的化合物,避免后期临床试验中的心脏安全性问题。浙江候选临床前研发合作准确的临床前药效分析,助力企业筛选出潜力候选药物。

环特生物在靶点发现阶段采用多组学联合分析策略,整合基因编辑、转录组测序及蛋白质组学技术,系统挖掘疾病相关关键靶点。例如,在神经退行性疾病研究中,通过CRISPR/Cas9技术构建斑马鱼α-突触he蛋白过表达模型,结合全脑成像技术,发现特定微小RNA(miRNA)可通过调控自噬通路减缓蛋白聚集,从而锁定miR-34a作为潜在干预靶点。在验证环节,环特利用类organ模型模拟疾病病理特征,例如构建阿尔茨海默病类organ,通过单细胞测序技术揭示Aβ斑块沉积对神经元亚群的影响,为靶点功能验证提供三维组织层面的证据。此外,其开发的斑马鱼荧光报告系统可实时监测靶点活性变化,如Tg(NF-κB:EGFP)转基因斑马鱼通过绿色荧光强度量化炎症信号通路启动程度,加速了靶点验证进程。
小分子药物临床前研究的关键目标是验证靶点生物学功能、明确药物作用机制,并为后续开发提供科学依据。靶点验证通常结合基因编辑技术(如CRISPR-Cas9)与细胞模型,通过敲除或过表达目标基因,观察细胞表型变化。例如,在BRAF突变型黑色素瘤研究中,研究者利用CRISPR敲除BRAF基因后,发现细胞增殖明显受抑,而回补突变型BRAF则恢复增殖,证实了该靶点的致ancer性。机制探索则依赖蛋白质组学、代谢组学等技术,解析药物对信号通路的调控。如EGFR抑制剂吉非替尼通过抑制下游AKT/mTOR通路,诱导肿瘤细胞凋亡,这一机制在临床前模型中得到验证,为后续临床试验设计提供了关键理论支持。此外,类organ模型因其保留患者tumor组织异质性的特性,成为机制研究的理想工具,可模拟药物在复杂微环境中的动态作用。杭州环特生物深耕临床前实验领域,为医药研发提供专业技术支撑。

新药临床前毒理学试验涵盖多种类型和方法。急性毒性试验是其中较为基础的一种,它通过给予动物单次或24小时内多次较大剂量的受试药物,观察动物在短期内出现的毒性反应,如中毒症状、死亡情况等,以此来初步确定药物的致死剂量范围和毒性靶organ。长期毒性试验则更为深入,通常会持续较长时间,按照拟定的临床给药的方案,分不同剂量组给予动物药物,密切监测动物在整个试验期间的体重变化、血液学指标、血液生化指标、组织病理学改变等,多方面评估药物长期使用对机体各系统功能和结构的影响。此外,还有特殊毒性试验,包括遗传毒性试验,检测药物是否会引起基因突变、染色体畸变等遗传物质的改变;生殖毒性试验,研究药物对生殖过程、胚胎发育、子代的生长发育等方面的作用;以及致ancer性试验,判断药物是否具有潜在的致ancer风险。这些不同类型的试验相互配合,从多个角度为新药的安全性评价提供丰富且准确的数据。环特生物临床前实验数据,可用于 NMPA 临床试验申报.宁波药品临床前毒理上市cro公司
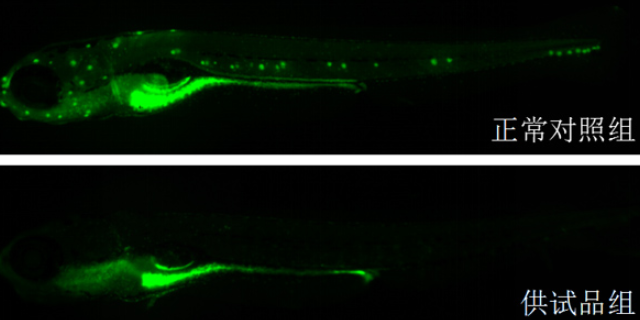
环特生物为化妆品研发,提供专业临床前实验安全评价。宁波药品临床前毒理上市cro公司
生物大分子的免疫原性是其临床前安全性评价的重点。即使人源化抗体仍可能引发抗药物抗体(ADA)产生,导致疗效降低或过敏反应。临床前需通过ELISA、流式细胞术及T细胞依赖性影响试验(TDAR)评估免疫原性风险。例如,在TNF-α抑制剂开发中,TDAR试验可检测药物对T细胞增殖及细胞因子分泌的影响,预测潜在免疫相关不良反应。脱靶毒性则需通过高通量筛选技术(如KinomeScan)评估药物对非靶标激酶的交叉结合能力,避免因脱靶效应导致的organ毒性。例如,某EGFR抑制剂因意外结合HER2受体,在临床前猴模型中引发严重心脏毒性,终导致项目终止。此外,重复给药毒性试验需持续观察动物体重、血液生化指标及组织病理学变化,为临床剂量设计提供依据。宁波药品临床前毒理上市cro公司